饮用水安全直接关系到城乡居民的身体健康及社会经济稳定发展,所以国家高度重视饮用水安全问题,相继发布了《全国城市饮用水安全保障规划(2006-2020年)》、《城市供水水质管理规定》、《水污染防治行动计划》等一系列文件,修订了《生活饮用水卫生标准》并于2012年7月1日起在我国全面实施,饮用水安全保障力度不断加大.针对目前我国原水微污染的水质状况,供水企业一方面通过改造和强化传统工艺,并增加预处理或深度处理工艺,使出厂水质达到新的标准,另一方面则通过强化消毒工艺和控制管网余氯量来保证管网水的微生物学指标达标.
经过工艺处理进入管网的饮用水中的微生物并不能完全被灭活,一旦条件变化(余氯衰减,残存的营养物质浓度变化等),有一部分就会在管网中繁殖和恢复活性,这其中还存在着活的但不可培养的微生物(viable but non-culturable, VBNC),这些微生物无法通过细菌培养的方法[6]检出. VBNC中如果存在致病菌,在适宜环境条件下复活并大量繁殖,则直接威胁到饮用水水质安全.因此,快速、准确地进行管网水微生物的定量定性,是供水企业能够迅速采取措施控制微生物生长繁殖,保证供水水质卫生安全的前提.近年来,国内外研究者不断采用新的细菌检测方法对细菌进行快速计数,取得了很好的效果.
为克服传统培养方法计数结果偏低、培养时间长以及部分微生物无法检出的局限性,本研究采用快速准确且操作相对简便的荧光显微镜直接镜检法,对配水管网水中的细菌进行计数和观察.本研究以活菌数占细菌总数的比值来表征试验管网水的整体细菌活性,并对饮用水中常见形态细菌以及整体细菌活性受余氯、温度、浊度、流速等因素影响的变化进行了分析,结果对快速预估配水管网中生物安全性风险具有一定意义,同时也有利于供水企业根据预估结果调整工艺参数、保障供水安全.
1 材料与方法1.1 试验管网与试验采样
虽然试验管网与实际配水管网的环境条件存在一些差异,但是采用试验管网能够根据试验需要来调节影响细菌生长的参数变化,更好地了解细菌数量和整体活性受多个因素影响的变化规律.为了模拟实际配水管网水中细菌的生长变化情况,按图 1所示,采用PE管、闸阀、流量计、循环水箱及离心泵等管件与设备,在实验室搭建了模拟配水管网.试验用水直接引自北方某市配水管网.装置启动后,首先投加次氯酸钠溶液使水中自由余氯的初始值接近实际水厂清水池出水的余氯值;其次通过试验用水的封闭循环来模拟饮用水在实际配水管网中的流动;最后在取样点采样进行试验.取样点选在模拟管网主干管上的中点,以间隔一定时间的采样分析结果,来模拟实际配水管网的沿程水质.本研究于2014年8月至2015年7月对选定取样点进行取样,水样按照标准方法采集后尽快送回实验室进行分析,并按照国家标准方法对研究需要的指标进行测定.

1.离心泵;2.止回阀;3.闸阀;4.取样龙头;5.密封与平衡装置;6.加药管;7.进水管;8.排水管;9.循环水箱;10.管网示意
图 1 模拟配水管网示意
1.2 仪器与药品
总余氯与自由余氯:使用HACH46 700-001型总氯-余氯仪;HACH-DPD自由余氯测定药剂,HACH-DPD总余氯测定药剂.浊度:HACH2100AN型浊度仪.细菌总数和活菌数:使用Olympus-BX51型荧光显微镜,采用吖啶橙(acridine orange)染色镜检.
吖啶橙是技术相对成熟的荧光镜检染色剂.它能够透过细胞膜,与细胞核内的DNA和细胞质内的RNA结合,并在波长为436~490 nm的激发光的激发下发出荧光.它与DNA结合可发射出黄绿色或绿色荧光,与RNA结合可发出橙色至鲜红色荧光.即使DNA在没有活性的细胞内,吖啶橙也能与其结合将其染色,因此可以用来计数细菌总数.
1.3 试验方法
细菌总数计数采用吖啶橙染色直接计数法[15](acridine orange direct counts,AODC).水样用无菌磨口玻璃瓶采集后迅速加入甲醛固定,甲醛最终含量2%.将0.5 mL含量为0.2%的吖啶橙(BBI公司)溶液加入10 mL固定后水样中,染色1~2 min.染色后的水样使用溶剂负压过滤器以微孔滤膜(孔径0.2 μm,直径47 mm,黑色聚碳酸酯膜,Millipore公司)过滤.将过滤后的滤膜置于载玻片上并固定,用落射荧光显微镜观察,计数发绿色或橙色荧光的菌体.显微镜光源为汞灯,激发光滤光片450~490 nm,光束分离滤光片510 nm,阻挡滤光片520 nm.随机选取10个视野的计数结果取平均值,根据视野面积和过滤面积的比值计算出单位体积水样中的细菌数量.
活菌数计数采用活菌直接计数法[16](direct viable counts,DVC-N.A).向10 mL水样中加入最终含量为0.002%的萘啶酮酸(nalidixic acid, N.A, BBI公司)和最终含量为0.025%的酵母膏(上海生工生物工程公司),25℃避光培养6 h后用甲醛固定.再将固定后的水样按照AODC法直接镜检计数,视野中长大或变粗的菌体被认为是活菌.
2 结果与分析2.1 细菌计数结果比较
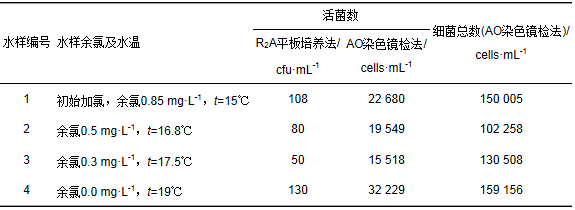
加氯后在试验管网取水点取样,随着余氯不断衰减取多组水样,并从中选取4组水样,分别使用R2A培养基平板计数和吖啶橙染色直接计数两种不同方法对水样中的细菌进行计数.每组水样均取等量的6份,即每种计数方法对每组水样平行测定3次,取计数结果的平均值.两种方法对4组水样中细菌的计数结果见表 1.使用R2A作为培养基的平板计数法得到水样中的活菌数在100~102 cfu·mL-1,而吖啶橙染色荧光显微镜直接镜检计数法得到水样中的活菌数在103~104 cells·mL-1,比使用R2A作为培养基的平板计数法高出1~3个量级,明显高于培养法.直接镜检计数法不仅能够计数活细菌,还能够计数受损和死亡细菌数量,得到水样中的细菌总数在104~105cells·mL-1.类似的试验在冬季也进行了运行,并与夏季运行的结果对比.冬季的HPC-R2A法计数结果在100~102 cfu·mL-1,检出量级更低,甚至有个别水样未检出.而镜检计数结果检出的量级仍在103~104cells·mL-1.且镜检法能够直观地观察到细菌的形态,有助于更好地掌握细菌的变化规律(见图 2).
表 1 R2A培养法和AO染色镜检法细菌计数结果比较
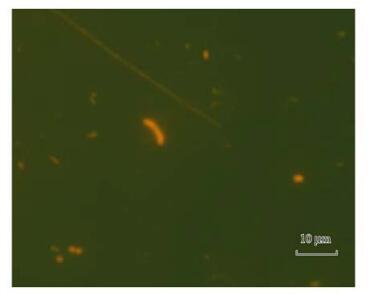
图 2 不同形态细菌
2.2 不同理化指标下细菌数量和总体活性的变化2.2.1 不同余氯量下细菌数量和总体活性的变化
采用活菌数与细菌总数的比值来表征管网中细菌的整体活性.细菌数量和总体活性与余氯衰减的关系见图 3.向循环水箱中投加次氯酸钠溶液后,马上开始取样测定.测定活菌数为22 680 cells·mL-1(各形态活菌占活菌总数的比例见表 2),活菌数占细菌总数的比例为15.12%.当余氯浓度达到最大值时,活菌的数量开始减少.此时水样中活菌数为21 088 cells·mL-1,活弧形菌所占比例显著降低(见表 2),在活菌比例最低时(达9.21%),活菌中短杆形菌所占的比例较余氯浓度最大时提高了5.8%,而此时球形菌和长杆形菌所占比例变化不大,弧形菌所占比例降至为0(见表 2).随着余氯的衰减,活菌所占比例不断增大,而且活菌中杆形菌的数量增速更快(图 4),平均数量增速(从活菌比例最低至循环结束时间段内)为46 cells·(mL·min)-1,而球形菌和弧形菌仅为30 cells·(mL·min)-1和7 cells·(mL·min)-1.当水中余氯浓度低于0.3 mg·L-1时,活菌在细菌总数中所占比例开始增大,最高可达到20.25%,远高于余氯浓度为0.52 mg·L-1时9.34%的活菌比例.
表 2 水循环中不同时刻各形态细菌所占比例
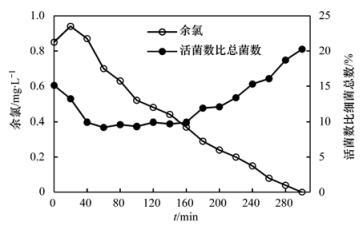
图 3 整体细菌活性受余氯影响的变化
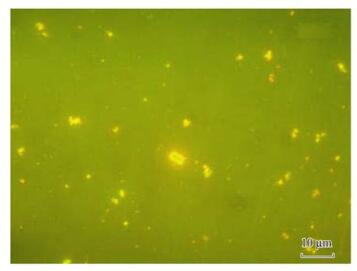
图 4 低残留余氯浓度水样中的活菌
2.2.2 不同温度下细菌数量和总体活性的变化
模拟管网用水来自以地表水为水源的市政管网,所以四季水温相差较大,冬季的试验水温一般低于11℃,而夏季的试验水温一般高于19℃.分别选取每月平行试验中余氯约为0.55、0.30和0.00 mg·L-1的水样,分析不同季节细菌数量和总体活性受水温影响的变化规律(图 5).在余氯低于0.3 mg·L-1时,活菌数占细菌总数的比值因为温度的不同而相差较大,可达2.48%.对比不同季节66份管网水样的镜检结果,未投加次氯酸钠时,夏季水样中杆形菌占细菌总数的62.8%~68.3%,高于冬季的52.9%~66.7%,而在活菌比例最低时夏季试验水样中杆形菌占细菌总数的45.1%~54.7%,低于冬季管网中的58.7%~62.6%,说明在水温较高时,杆形菌对次氯酸钠的耐受性变差.另外,在夏季水样中存在许多活的短杆形菌(见图 6),是冬季水样中少见的.
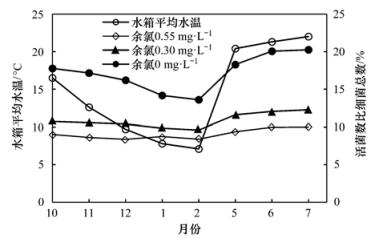
图 5 整体细菌活性受不同月份水温的影响

图 6 夏季水样中经过培养的活短杆形菌
2.2.3 不同浊度下细菌数量和总体活性的变化
为了研究浊度与细菌数量之间的关系,取不同季节不同循环未投加消毒剂之前的试验循环水,样品编号按浊度由小到大排列,分别测定了浊度和活菌数,结果见图 7.浊度与活菌数之间的相关系数高达0.979 8.

图 7 活菌数与浊度的相关性
余氯约为0.3 mg·L-1时不同浊度下的计数结果(图 8),浊度最大值2.28 NTU,最小值1.64 NTU,相差0.64 NTU;活菌数占细菌总数的比值相应地相差2.95%.浊度超过2 NTU时,活菌数比例增大明显.由于试验采用的是自建的管网,每次运行前虽然对管网进行冲洗,但难免会有少量的搭建管网时残留的管材碎屑.另外,运行前的冲洗突然改变了管网的水力条件,冲刷下了管壁附着的细菌及沉淀物质,也增加了试验用水的浊度.并且,试验用水引自的管网是年代较远的传统管材管网,其中的水自身浊度较高.上述原因造成了试验水浊度基本高于0.5 NTU.
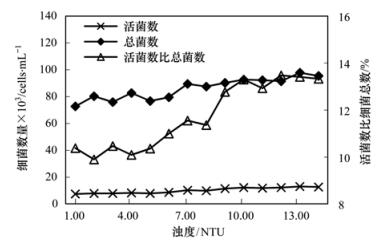
图 8 整体细菌活性受浊度的影响
2.2.4 不同流速下细菌数量和总体活性的变化
为了缩短研究时间,尽快取得管壁生物膜,所以试验管网在设计和运行时均考虑到流速的问题,使实际运行的流速低于经济流速.试验配水管网中水的流速通过每个管段上的阀门控制在0.4~1.7 m·s-1.被冲刷下来的生物膜会悬浮在水样中,在染色过滤时被截留在微孔滤膜上.由图 9可见被冲刷下的生物膜内存在活菌.
图 9 被冲刷下来的管壁生物膜
在封闭循环试验结束后,保持主干管流量为1 m3·h-1运行(采用非循环方式)18 h,分别在试验管网始端管段的上游和下游龙头取水样(样品1和2),之后迅速旋该管段上下游阀门至开启度最大,并同时在这两个龙头再取水样(样品3和4),分别测定4个水样中活菌数和细菌总数,测定结果见图 10.可见流速的突然增大从管壁上冲刷下生物膜,引起了水中细菌数量的增多,尤其是活菌数量的增幅更大,导致水中整体细菌活性增强.因此,尽量避免引起流速突变(如水锤等现象),防止管网中流速突然增大,也是控制饮用水中细菌数量激增的有效措施.
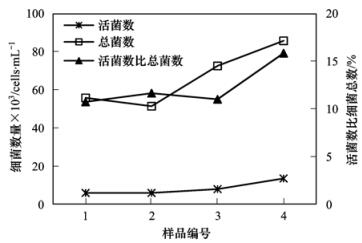
图 10 整体细菌活性受流速的影响
3 讨论3.1 细菌计数方法的比较
琼脂平板计数法(agar plate counts)是至目前国内应用最广泛且使用时间最长的饮用水中异养菌的计数方法.近年来也有很多研究者使用R2A培养基进行平板培养计数来克服受损菌体不能在营养琼脂培养基上正常生长的局限性,使计数结果更高.但是培养基为细菌提供的生长环境还是与饮用水系统的贫营养环境差异较大,使用培养方法检测饮用水系统中的所有细菌还是难以获得较为准确的结果,有个别样品还会因为涂布时的操作不当造成污染而得不到计数结果.并且使用HPC-R2A法培养,细菌生长缓慢,数量一般从培养的第4 d、第5 d开始才增多较快,那么要想得到准确的计数结果,采用常规的7 d培养法是不够的,不能使供水企业迅速地得到细菌数量超标的信息并及时采取控制措施.虽然扫描电镜使视野清晰,但是对于观察前细菌的分离技术要求较高,且前处理时间也稍长,所以还多用于对观察细菌形态.利用流式细胞术、ATP方法、分子探针、基因芯片等测定饮用水中的微生物也能快速获得相对准确的计数结果,但是对操作人员的要求较高,也不能作为供水企业的首选.而荧光显微镜镜检法可以直接对水样中的细菌进行计数,对细菌的生长环境改变不大.而且荧光显微镜观察计数十分快捷,从取样至检出只需30 min左右.显微镜直接镜检计数法快捷、稳定、经济性好,是在实际应用中对饮用水管网中细菌进行快速计数的可行方法.
3.2 细菌数量和整体活性受理化指标影响的变化规律3.2.1 细菌数量和整体活性受余氯影响的变化规律
由前述试验结果可知,在投氯的初始时刻,消毒剂中的有效成分还未完全对微生物产生作用,活菌的比例还很高.余氯浓度最大时,弧形菌比例较初始时刻大幅降低,而其它形态细菌比例变化没有过于明显,说明配水管网水中的大部分种属的弧形菌对次氯酸钠消毒剂的耐受力较杆形菌和球形菌弱.活菌比例最低时,短杆形菌比例升高而弧形菌比例几乎降至为零,长杆形菌和球形菌比例变化不大,说明配水管网水中的短杆形菌对次氯酸钠消毒剂的耐受能力最强.另外,余氯对于细菌的灭活相对于余氯衰减存在时间上的滞后性,即余氯浓度最大时,活菌比例并未达降至最低,尤其是对于菌胶团中细菌的灭活.随着余氯衰减,杆形菌比例增长明显,说明杆形菌的繁殖和活性恢复能力较强.活弧形菌的再次出现说明消毒剂并不能完全杀灭水中的细菌,而是杀灭一部分细菌,对另一部分细菌仅能发挥抑制活性作用.所以这时虽然水中仍存有一定浓度的余氯,但是已不能有效地控制细菌的繁殖和活性恢复.
3.2.2 细菌数量和整体活性受温度影响的变化规律
水温高时整体细菌活性较强,因为水温高有利于细菌的繁殖.而且水温高时余氯的衰减加快,也相应减小了余氯的灭活作用.水温高时杆形菌比例相对低,说明杆形菌对温度较高时的消毒剂较敏感,即杆形菌对热力消毒敏感.根据地下水和地表水的水温特点,由以上分析可知,夏季的地表水更有利于细菌的生长繁殖和活性恢复,所以采用地表水水源的水厂在夏季更应关注微生物学指标.
3.2.3 细菌数量和整体活性受浊度影响的变化规律
水中的微生物会附着在悬浮颗粒上呈离散的非溶解状态,这些悬浮颗粒给微生物的生长繁殖提供了保护.所以美国在2002年把浊度列入了微生物学指标,指标限值也更为严格.由试验结果可知配水管网水中的浊度大则细菌数量多,整体细菌活性也强,说明活菌受到了悬浮颗粒包裹物的保护.实测的浊度与活菌数之间的相关系数高达0.979 8,即微生物繁殖和复活在一定程度上也取决于浊度的高低.因此,控制出厂水及配水管网中的浊度水平,对于控制活菌数也是有效措施.
3.2.4 细菌数量和整体活性受流速影响的变化规律
当流速大时由于水力剪切作用,附着在管壁上的生物膜会被水流冲刷下来,并随着水流流向管网下游,造成细菌数量的激增.并且这些生物膜给细菌的生长繁殖和避开灭活提供了保护.流速的增大使得从管壁上冲刷下更多的生物膜,引起了水中细菌数量的增多,尤其是活菌数量的增幅更大,导致水中整体细菌活性增强.因此,尽量避免管网中流速突然增大,也是控制饮用水中细菌数量激增的有效措施.
3.3 吖啶橙染色荧光显微镜直接镜检法需要注意的问题
吖啶橙不但可以将水中的微生物染色,还可将部分杂质染色,因此镜检观察时应只计数细胞形态的荧光物.水样要充分过滤,否则残留在膜上的水痕会干扰观察.观察计数每个视野前应使部分干扰物的荧光淬灭.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
4 结论
(1) 吖啶橙染色荧光显微镜直接镜检应用于计数模拟配水管网中的微生物数量能够得到较稳定的结果.计数得到水样中的活菌数在103~104cells·mL-1,比使用R2A作为培养基的平板计数法高出1~3个量级;水样中的细菌总数在104~105cells·mL-1.每个水样的镜检时间仅需30 min左右.所以吖啶橙染色荧光显微镜直接镜检是对配水管网中细菌进行计数的较优方法.
(2) 模拟配水管网水中整体细菌活性与水温、浊度和流速都存在正相关关系;与运行稳定后的余氯存在负相关关系.可根据细菌活性确定不同季节和原水水质下的更准确的投氯量.
(3) 模拟配水管网水中常见形态的细菌对次氯酸钠消毒剂的耐受能力依次为:短杆形菌>球形菌>长杆形菌>弧形菌,并且杆形菌恢复活性和再繁殖的能力较强.夏季水样中短杆形菌多于冬季.