铬作为一种备受关注的重金属污染物,近15年来已经被列入超级有害物质20种优先名单.水环境中铬的主要存在形态是Cr (Ⅲ)和Cr (Ⅵ),其中Cr (Ⅵ)的毒性是Cr (Ⅲ)的100~1 000倍,已被美国环境保护署定义为A类致癌物质.不锈钢合金生产、金属电镀工业、皮革工业和树木防腐剂的使用都会引起铬的环境污染;受污染地下水中铬的浓度一般处于2~22 mg·L-1范围,世界卫生组织(WHO)规定饮用水中Cr (Ⅵ)不能超过50 μg·L-1.长期暴露在Cr (Ⅵ)污染环境中给人体带来巨大的健康危害,如导致胃肠道和皮肤疾病以及血液功能异常等.
Cr (Ⅵ)污染地下水的主要修复方法包括还原沉淀法、吸附法、离子交换法及反渗透法,通常采用化学还原剂将Cr (Ⅵ)还原成Cr (Ⅲ),然后改变pH条件或加入沉淀剂生成Cr (Ⅲ)沉淀,从而降低水溶液中Cr (Ⅵ)的浓度.主要的化学还原剂有还原性铁粉、亚硫酸盐、多硫化钙等.还原沉淀法操作较为方便,去除效率高,在国内外应用较广.但是,对于在由于还原Cr (Ⅵ)可能导致的还原条件下某些环境污染物毒性会增大的水体难以采用这种方法进行处理.一些矿区周边地下水同时受到Cr (Ⅵ)和As (Ⅴ)的污染,如我国包头市某地区地下水中出现Cr (Ⅵ)、As (Ⅴ)同时超标的现象[7];针对这种情况,如果选用还原稳定法进行处理,会在将Cr (Ⅵ)还原成Cr (Ⅲ)的同时,又将As (Ⅴ)还原为毒性更大的As (Ⅲ),从而造成As的环境毒性更大.
当前,相关研究已经证明采用吸附法修复As (Ⅴ)污染地下水是一种比较有效的方法,施氏矿物由于其经济性、操作方便性、无二次污染物等优点被广泛应用于As (Ⅴ)的治理中.施氏矿物是一种常出现于酸性矿山废水中的铁系矿物,其化学组成可表示为Fe8O8(OH)8-2x(SO4)x(x为1~1.75);施氏矿物的性质与铁硫比有较大的关系,其比值除了受到环境中硫酸根浓度和pH的影响外,还与施氏矿物形成的方式有关.有研究表明酸性矿山废水中的施氏矿物在富集重金属砷的同时也会富集铬,其富集量可以达到812 ng·L-1(Cr)[10].陈福星等在对生物合成施氏矿物对Cr (Ⅵ)的去除研究中发现pH值为6~8时施氏矿物对Cr (Ⅵ)的去除能力最佳.此外,还有研究者将施氏矿物作为一种催化剂,催化Cr (Ⅵ)还原成Cr (Ⅲ),从而使Cr (Ⅵ)从污染水体中去除.施氏矿物人工合成一般有生物合成法和化学合成法;目前的研究中多采用生物合成法处理含铬废水,处理能力为35.3~55mg·g-1.但是,施氏矿物生物合成过程较复杂,相比较简单快捷的化学合成方法而言,难以大规模地实际应用.
当前国内外对生物法合成施氏矿物的研究主要考察其处理砷、铬等重金属污染废水的效果及影响因素,本研究探究了人工化学合成的施氏矿物对Cr (Ⅵ)污染地下水的吸附修复可行性,考察合成施氏矿物对地下水溶液中Cr (Ⅵ)的吸附动力学和吸附等温线,分析其Cr (Ⅵ)去除性能;开展批实验研究pH值、有机物、地下水中常见无机离子等环境条件对施氏矿物吸附地下水中Cr (Ⅵ)的影响.
1 材料与方法1.1 材料
实验中Cr (Ⅵ)储存液采用优级纯重铬酸钾和去离子水(电阻率ρ>18.2 MΩ·cm)配制;其他试剂除了特殊说明外,均使用分析纯.
1.2 施氏矿物的制备
主要应用Regenspurg等的快速化学制备方法实验室合成实验用施氏矿物.具体方法如下:将3 mL H2O2(30%)缓慢加入溶有5.56 g FeSO4·7H2O的溶液中,定容至250 mL,定容后转移到系列容量为500 mL的三角瓶中;控制温度在(28±1)℃,在往复式摇床振荡反应24 h,转速为180 r·min-1;反应结束后用0.45 μm的滤膜抽滤,使用蒸馏水清洗,再抽滤(重复5次);50℃烘箱烘干约24 h,恒重.制备的施氏矿物过200目筛(孔径0.075 mm),干燥、密封、避光保存.
1.3 吸附实验1.3.1 Cr (Ⅵ)的吸附动力学研究
在250 mL的具塞锥形瓶中进行,溶液总体积为100 mL,施氏矿物含量为0.5 g·L-1,水平振荡器转速为180 r·min-1,温度条件为(25±1)℃,设定Cr (Ⅵ)初始浓度分别为5、50、450 mg·L-1这3个浓度水平. pH在4.5和8条件下,在设定的反应时间间隔内,取适量悬浮液通过孔径0.45 μm滤膜过滤,测定滤液中Cr (Ⅵ)浓度,绘制Cr (Ⅵ)浓度随反应时间的变化曲线.
1.3.2 吸附等温线
称取0.05 g施氏矿物在一系列250 mL的具塞锥形瓶中,配制pH=6的施氏矿物悬浮液,Cr (Ⅵ)初始浓度为0~200 mg·L-1,总反应体积为100 mL,振荡(180 r·min-1,25℃±1℃)反应24 h.反应结束后,取适量悬浮液通过孔径0.45 μm滤膜过滤,并测定滤液中Cr (Ⅵ)浓度.
1.3.3 施氏矿物投加量影响
在不同施氏矿物投加量下(0、0.5、1、5 g·L-1),模拟化学合成施氏矿物修复Cr (Ⅵ)污染地下水的影响. Cr (Ⅵ)初始浓度分别为5、50、450 mg·L-1,pH值为4.5.其他条件和操作程序同1.3.2节.
1.4 环境条件影响
在其他条件保持不变的情况下,变动pH值、有机物、无机离子(SO42-、Cl-、HCO3-、Ca2+和Mg2+)等条件,模拟研究这些因素可能对施氏矿物修复Cr (Ⅵ)污染地下水的影响.在250 mL的具塞锥形瓶中进行,溶液总体积为100 mL,室温25℃±1℃条件下,设定Cr (Ⅵ)初始浓度分别为5 mg·L-1,施氏矿物含量为0.5 g·L-1,水平振荡器转速为180 r·min-1,模拟实验的反应时间为24 h.
在pH值、有机物、无机离子的影响实验中,pH值分别设定为3、4.5、6、8和10,考察了pH=6和8时,5个有机物的浓度水平(0、0.5、5、10、20 mg·L-1)和SO42-、Cl-、HCO3-、Ca2+和Mg2+等常见阴阳离子对施氏矿物去除Cr (Ⅵ)的影响.
1.5 表征和测定方法
采用XRF (X Ray Fluorescence, Innov-X systems α-4000)对施氏矿物化学元素组成进行分析;采用XRD (X-ray diffraction, XRD-7000 S/L,日本)对施氏矿物进行物相分析,扫描速度为2(°)·min-1,采样间隔为0.02°,扫描范围10°~80°;采用场发射扫描电子显微镜(SEM,JSM-7800F,JEOL公司)对施氏矿物进行表观形貌分析. BET比表面积(BET)采用Micromeritics公司的ASAP2020比表面分析仪利用N2吸附法进行测试,测试温度为77 K.
使用梅特勒-托利多pH计测定pH值,采用中华人民共和国国家标准(GB/T 7467-1987)中的二苯碳酰二肼分光光度法利用紫外-可见分光光度计(T6,北京普析)测定液相中Cr (Ⅵ)浓度.
2 结果与讨论2.1 施氏矿物的制备与表征
化学合成的施氏矿物如图 1,呈棕黄色,与自然界中的施氏矿物颜色基本一致[5].对其过200目筛(孔径0.075 mm),保存备用. 图 1(b)为合成的施氏矿物在电子扫描显微镜放大5 000倍的SEM图,从中可以看出该矿物成细小球状,颗粒轮廓圆滑,根据电子扫描显微镜图谱的比例尺得出,粒径大概在300~1 000 nm之间,与王鹤茹等采用化学法合成的施氏矿物粒径(600~800 nm)接近.
(a) 施氏矿物; (b) SEM图
图 1 化学合成的施氏矿物、SEM图
XRD图谱如图 2.根据标准施氏矿物(PDF47 177),所有的峰对应的d值为0.486、0.339、0.255、0.228、0.195、0.166、0.151、0.146;根据2dsinθ=λ,算出对应的2θ值为18.360°、26.258°、35.150°、39.476°、46.516°、55.272°、70.300°、78.952°.典型衍射峰位于2θ=35.15°处,出现位置与标准峰基本一致,说明合成产物为施氏矿物.此外,XRD谱线有很多毛刺,表明其结晶度较差或者是无定型矿物.
图 2 施氏矿物XRD图谱
通过对合成的施氏矿物XRF元素分析,得到其化学组成为Fe8O8(OH)5.28(SO4)1.36,Fe/S为5.88,符合施氏矿物化学通式Fe8O8(OH)8-2x(SO4)x·nH2O (y=8-2x,1.0≤y≤1.75).本研究合成的施氏矿物的Fe/S与梁剑茹等通过生物法合成的施氏矿物Fe/S摩尔比(4.06)接近. BET分析表明其比表面积为4.307 3 m2·g-1,与Regenspurg等报道的4~14 m2·g-1比表面积一致,吸附平均孔体积为0.007 5 cm3·g-1,平均孔径为6.93 nm,属介孔材料.
2.2 施氏矿物对Cr (Ⅵ)的吸附实验2.2.1 施氏矿物吸附Cr (Ⅵ)的动力学研究
如图 3和图 4所示,Cr (Ⅵ)初始浓度为5 mg·L-1,pH 4.5和8时,分别有86%和60%的Cr (Ⅵ)得到去除,12 h后反应均达到平衡.随着Cr (Ⅵ)浓度的增加,Cr (Ⅵ)的去除率有所降低,Cr (Ⅵ)初始浓度为50 mg·L-1,pH 4.5和8时,Cr (Ⅵ)的去除率都仅为40%,12 h后反应均达到平衡;Cr (Ⅵ)初始浓度为450 mg·L-1时,Cr (Ⅵ)的去除率都不足10%.以上结果表明,该化学合成的施氏矿物去除Cr (Ⅵ)在24 h内可以达到平衡,比较适合处理低浓度Cr (Ⅵ)地下水,同时酸性条件利于地下水中Cr (Ⅵ)的去除.
25℃,180 r·min-1,c0为5、50、450 mg·L-1,施氏矿物为0.5 g·L-1
图 3 pH=4.5时Cr (Ⅵ)浓度随时间的变化
25℃,180 r·min-1,c0为5、50、450 mg·L-1,施氏矿物为0.5 g·L-1
图 4 pH=8时Cr (Ⅵ)浓度随时间的变化
为定量描述施氏矿物对Cr (Ⅵ)的吸附去除动力学,分别采用Lagergren一级速率方程、Lagergren二级速率方程以及粒子内部扩散模型来进行拟合.
Lagergren一级速率方程:
Lagergren二级速率方程:
粒子内部扩散模型:
式中,Qe和Qt分别表示Cr (Ⅵ)平衡时刻吸附量和t时刻吸附量(mg·g-1);K1、K2、ki表示各自模型的反应速率常数;C为常数.
准一级和准二级参数拟合结果见表 1,内部扩散模式参数拟合结果见表 2,通过比较3个方程拟合得到的相关系数发现,Lagergren二级速率方程能较好地描述Cr (Ⅵ)吸附动力学过程.将得到的参数进行假设检验,在置信度为95%时证明Cr (Ⅵ)的去除最符合Lagergren二级速率方程(图 5). Lagergren二级速率方程说明施氏矿物吸附Cr (Ⅵ)的吸附速率受化学吸附机制的控制,吸附过程涉及吸附剂和吸附质之间的电子共用或电子转移,即化学法合成施氏矿物对Cr (Ⅵ)的吸附可能主要以化学吸附为主,涉及离子交换反应[Cr (Ⅵ)与-OH,SO42-]、络合反应等.对施氏矿物吸附Cr (Ⅵ)前后进行STEM-EDS分析检测,施氏矿物吸附Cr (Ⅵ)后,内部和边缘均分布着一定量的Cr元素,进一步证明施氏矿物吸附Cr (Ⅵ)涉及离子交换反应和络合反应等.
表 1 Cr (Ⅵ)吸附动力学准一级和准二级模型参数拟合结果
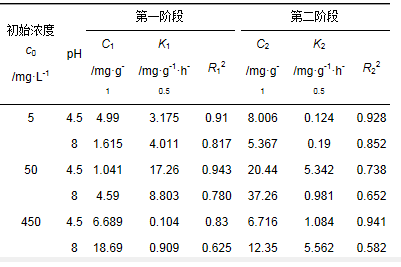
表 2 内部扩散模式参数拟合结果
25℃, 180 r·min-1, c0为5、50、450 mg·L-1, 施氏矿物为0.5 g·L-1
图 5 Lagergren二级速率方程数据拟合
2.2.2 施氏矿物对Cr (Ⅵ)的吸附等温线
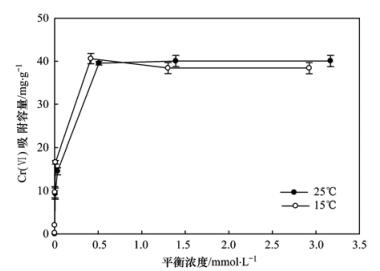
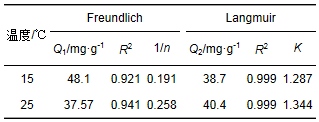
不同温度条件下施氏矿物对Cr (Ⅵ)的吸附等温线如图 6所示,可以看出,25℃时,pH=6,施氏矿物为0.5 g·L-1时,施氏矿物对Cr (Ⅵ)最大吸附去除量可以达到40.4 mg·g-1.陈福星[19]采用生物合成的施氏矿物去除水体中的Cr (Ⅵ)时发现,pH=5时,最大吸附量为16 mg·g-1.对比发现通过化学合成的施氏矿物对Cr (Ⅵ)的去除能力是较强的,同时,温度降低,吸附容量减小了4%,说明温度对施氏矿物对吸附Cr (Ⅵ)的影响较小.
180 r·min-1, 施氏矿物为0.5 g·L-1, pH=6
图 6 施氏矿物对Cr (Ⅵ)的吸附等温线
采用Langmiur和Freundlich[20]方程对施氏矿物吸附去除Cr (Ⅵ)的吸附等温线进行拟合.
Langmiur方程:
Freundlich方程:
式中,qe代表吸附剂的吸附量(mg·g-1);b是Langmiur常数,代表吸附剂施氏矿物与Cr (Ⅵ)的结合能力,ce为平衡时的溶液Cr (Ⅵ)浓度(mg·L-1),K是Freundlich常数,1/n反映吸附的非线性度,其值越大则表示吸附能力越弱.
拟合结果见表 3,Langmiur方程和Freundlich方程都能较好地描述Cr (Ⅵ)的吸附等温过程,但通过比较R2值以及实际吸附量,Langmiur方程拟合效果更好,相应的其转化后的线形方程为:
表 3 Cr (Ⅵ)吸附等温线常数
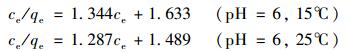
通过考察15℃、25℃时温度对施氏矿物吸附Cr (Ⅵ)的吸附等温线(见图 6),结果表明实验温度范围内,吸附量随温度升高而升高,表明施氏矿物吸附Cr (Ⅵ)是一个吸热过程.依据吉布斯方程计算温度对吸附平衡常数的影响:

式中,ΔGθ为吸附的标准自由能改变量(kJ·mol-1),ΔHθ为标准吸附热(kJ·mol-1),ΔSθ为吸附的标准熵变值[J·(mol·K)-1],R为气体摩尔常数[J·(mol·K)-1],T为绝对温度(K),Kads为吸附平衡常数(mL·g-1),根据郭文娟等提供的方法,以lnqe/ce对Qe作图并进行线性拟合,Qe=0时对应的lnqe/ce得到lnKads.不考虑温度对ΔHθ和ΔSθ的影响,求得ΔHθ=6.368 kJ·mol-1,室温下ΔGθ=-1.215 kJ·mol-1.室温下,ΔGθ<0,从另一个侧面反映出施氏矿物吸附Cr (Ⅵ)的反应可以自发进行,即施氏矿物可以自发的吸附Cr (Ⅵ).
吸附是吸附质和吸附剂间各种作用力共同作用的结果,不同作用力在吸附中所放出的热量有所区别,Von Oepen等测定各种作用力引起的吸附热的范围(见表 4),施氏矿物吸附Cr (Ⅵ)的吸附热为6.368 kJ·mol-1,故推断其主要吸附机制可能为氢键力、范德华力、疏水键力、偶极间力,而不是配位基交换或者化学键.
表 4 各种作用力引起的吸附热/kJ·mol-1
此外,无量纲Langmuir分离因子RL=1/(1+Kc0)通常用来检验该吸附过程是否是有利于施氏矿物吸附Cr (Ⅵ),式中c0代表Cr (Ⅵ)离子的初始浓度(mg·L-1),K为Langmiur方程中的K值.当0 < RL < 1时,吸附过程有利于施氏矿物吸附Cr (Ⅵ);RL > 1、RL=1、RL=0分别代表不利于吸附、线性吸附、不可逆吸附.计算RL,并绘制RL-c0变化曲线图(见图 7),进一步考察了化学合成施氏矿物与Cr (Ⅵ)离子之间的亲和程度.可以很明显地看到,在两个温度下,Cr (Ⅵ)的去除过程中RL值自始至终均介于0和1之间,表明该吸附过程有利于施氏矿物吸附Cr (Ⅵ);RL值随着Cr (Ⅵ)初始浓度的不断增加而逐渐减小,接近于0,表明随着Cr (Ⅵ)初始浓度的增加,该吸附过程变得不可逆.
施氏矿物为0.5 g·L-1, pH=6
图 7 RL-c0变化曲线
2.2.3 施氏矿物投加量对吸附Cr (Ⅵ)的影响
施氏矿物投加量的加大意味着体系中Cr (Ⅵ)周围的施氏矿物浓度局部增大,Cr (Ⅵ)离子与施氏矿物接触几率增大,从而使吸附效果增强.施氏矿物投加量对溶液中Cr (Ⅵ)去除效果的影响见图 8.从中可以看出,pH=4.5时,溶液中Cr (Ⅵ)的去除率随施氏矿物投加量的增大而升高;在不同的Cr (Ⅵ)初始浓度条件下,当施氏矿物投加量由0.5 g·L-1增加至5 g·L-1时,施氏矿物对Cr (Ⅵ)的去除率都有所提高. Cr (Ⅵ)浓度为450 mg·L-1时,去除率可由10%增大到37.4%;Cr (Ⅵ)浓度为50 mg·L-1时,去除率可由42.6%增大到74.8%;Cr (Ⅵ)浓度为5 mg·L-1时,增大施氏矿物的投加量,可使处理后体系中Cr (Ⅵ)含量达到地下水质量标准[GB 14848-93Ⅳ类(0.1 mg·L-1)].然而从图 8中也可以看出,施氏矿物对溶液中Cr (Ⅵ)的去除能力也随投加量的增大而降低,即投加量高的体系对施氏矿物的利用率比投加量低的体系有明显的降低,这主要是由于施氏矿物投加量的增加,会导致施氏矿物形成一定的团聚,单位量的施氏矿物与Cr (Ⅵ)接触减少,从而导致单位施氏矿物的吸附能力降低.
25℃, 180 r·min-1, pH=4.5
图 8 不同施氏矿物投加量对吸附Cr (Ⅵ)的影响
2.3 环境条件的影响2.3.1 pH值
施氏矿物吸附去除Cr (Ⅵ)过程中pH值的影响见图 9.可以看出当pH值在3~6之间时,Cr (Ⅵ)的去除率随pH值升高而增大;pH值在6~10之间时,Cr (Ⅵ)的去除率随pH值的升高而下降,pH值的变化对施氏矿物去除Cr (Ⅵ)的影响较大.可以看出当pH值处于4.5~6之间时,Cr (Ⅵ)的去除效果较好,pH值为6时,Cr (Ⅵ)去除效果最好,去除率高达93.11%,而强酸和强碱性条件都不利于施氏矿物去除Cr (Ⅵ).陈福星[19]认为pH在2~7范围内,生物合成施氏矿物对Cr (Ⅵ)的去除效率随着pH值升高而提高,而当pH > 7时,去除效率随着pH的升高而降低;Antelo等研究发现在pH为4.5、7.0、8.0、9.0条件下,pH为4.5时,透析法合成施氏矿物对Cr (Ⅵ)去除能力最强.
pH值对施氏矿物对Cr (Ⅵ)的去除效果的影响主要存在两个机制:① 影响施氏矿物表面正电荷基团的数量,从而影响其对含氧阴离子的吸附能力;② 影响含氧阴离子的离子半径和所带电荷,从而影响其与施氏矿物中的SO42-的离子交换能力.其实,这两方面是相互影响的.施氏矿物的pHpzc在4.2~7.2之间.当溶液的pH < pHpzc时,施氏矿物表面带正电荷,容易吸附阴离子[式(1)].
25℃,180 r·min-1,c0为5 mg·L-1,施氏矿物为0.5 g·L-1
图 9 pH值对施氏矿物吸附Cr (Ⅵ)的影响
当pH > pHpzc时,施氏矿物表面带负电荷,容易吸附阳离子[式(2)].因此,当溶液中的pH值>7.2时,施氏矿物表面正电荷极少,会对CrO42-产生排斥,使其很难进入施氏矿物内与SO42-进行交换,且此时由于溶液内OH-急剧增多[26],使结构内SO42-溶出,导致含氧阴离子无法进行离子交换.
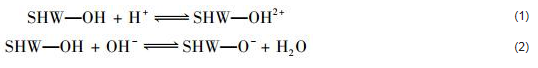
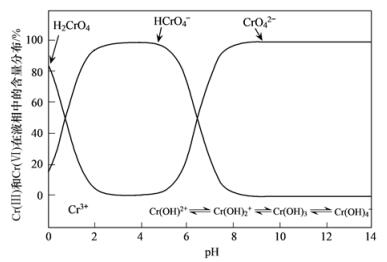
Cr (Ⅵ)在3.0 < pH < 6.0的水溶液中的主要化学形态是HCrO4-,而在pH > 7.0溶液中Cr (Ⅵ)则以CrO42-的形态为主[27],具体转化过程为:

当环境pH=4.5时,Cr (Ⅵ)在水溶液中的主要化学形态是HCrO4-;而当pH=6时,Cr (Ⅵ)在水溶液中的主要形态是HCrO4-和CrO42-(图 10),带有两个负电荷的含氧阴离子与SO42-带有相同的电荷,更易发生离子交换.所以pH=6时,施氏矿物对Cr (Ⅵ)的去除效果达到最佳.
Cr (Ⅵ)浓度小于1 mmol·L-1
图 10 不同pH值条件下Cr (Ⅵ)的存在形式及分布
2.3.2 有机物
地下水中溶解性有机物的浓度通常保持在0.5~10 mg·L-1[28],溶解性有机物中富里酸能够溶解的pH范围较广,既可溶于酸性环境,又可溶于中性和碱性环境.通过改变富里酸浓度水平,可考察其对施氏矿物吸附去除地下水中Cr (Ⅵ)的影响.
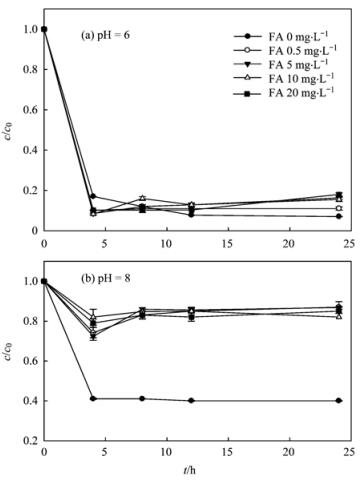
由图 11可知,在弱酸性条件下,当pH=6时,体系中富里酸浓度分别为0、0.5、5、10、20 mg·L-1时,施氏矿物对溶液中Cr (Ⅵ)的去除率分别为93.12%、90.1%、84.4%、83.4%和80.1%,Cr (Ⅵ)的去除率随富里酸浓度的增大而降低,但是降低不明显.在弱碱性条件下,当pH=8时,Cr (Ⅵ)去除率随富里酸的浓度的升高明显降低,去除率由62%降至19%.对比图 11可以发现,当水溶液中有富里酸存在时,pH值对施氏矿物去除Cr (Ⅵ)的过程有较大的影响,弱酸性环境富里酸对施氏矿物去除Cr (Ⅵ)影响较小,弱碱性环境富里酸对施氏矿物去除Cr (Ⅵ)有显著抑制.
25℃, 180 r·min-1图 11 有机物对施氏矿物吸附Cr (Ⅵ)的影响
此现象可能是以下两个原因造成:① pH=8(pH > pHpzc)时,施氏矿物表面带负电荷,容易吸附阳离子,从而对CrO42-产生排斥,使其很难被施氏矿物吸附;② 与富里酸本身特性有关,富里酸作为一种弱酸,其解离常数pKa值是4.5,一般只有在碱性介质中才能离解.当环境pH=6时,富里酸几乎不解离,其形态类似不带电的一般分子,此时富里酸对施氏矿物吸附Cr (Ⅵ)影响不大;而当pH=8时,富里酸离子化程度增加,表现为一种大分子量的阴离子,从而与Cr (Ⅵ)竞争吸附施氏矿物,与此同时,施氏矿物容易吸附阳离子,所以该条件下,富里酸对施氏矿物吸附Cr (Ⅵ)有一定的抑制作用.
2.3.3 无机离子
天然的地下水由于长期和岩石、土壤发生化学反应,是一种复杂的溶液,主要包括3种阴离子(Cl-、HCO3-、SO42-)和4种阳离子(Na+、K+、Ca2+、Mg2+)[30],其中,Cl-含量一般为每升水几到几十毫克;HCO3-在地下水中的浓度为50~400 mg·L-1[31];SO42-在地下水中的浓度为40~200 mg·L-1;Ca2+、Mg2+广泛分布于多种矿物质中,是地下水硬度的主要组成部分,Ca2+浓度为20~80 mg·L-1,Mg2+浓度为10~480 mg·L-1.而这些阴、阳离子也可能对施氏矿物的Cr (Ⅵ)吸附能力有一定影响.
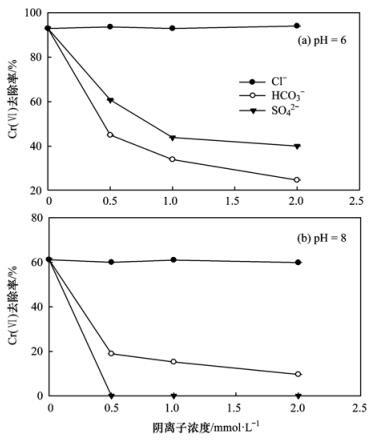
对于阴离子而言,图 12为地下水中Cl-、HCO3-、SO42-对施氏矿物去除Cr (Ⅵ)效率的影响.可以看出pH=6和pH=8的情况下,Cl-对吸附过程无影响,而HCO3-、SO42-均对该过程有明显的抑制作用. Regenspurg等[33]在研究施氏矿物对Cr (Ⅵ)的去除时发现,施氏矿物对含氧阴离子的结合能力与其所带电荷和离子半径大小有关,SO42-、HCO3-与CrO42-的离子半径比较接近(表 5),在吸附的过程中会形成竞争关系,所以HCO3-、SO42-会与CrO42-相竞争,影响施氏矿物对CrO42-的去除.陈福星在研究生物合成施氏矿物对Cr (Ⅵ)的吸附时也发现SO42-对施氏矿物吸附Cr (Ⅵ)的过程有抑制作用.
25℃,180 r·min-1图 12 阴离子对施氏矿物吸附Cr (Ⅵ)的影响
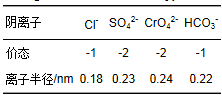
表 5 典型阴离子的电荷和离子半径
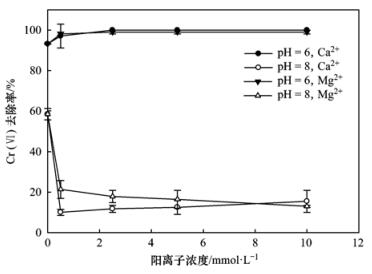
图 13为典型阳离子Ca2+、Mg2+在pH=6和pH=8时对施氏矿物吸附Cr (Ⅵ)的影响.从中可以在看出pH=6的条件下,Ca2+、Mg2+对施氏矿物去除Cr (Ⅵ)基本无影响.在pH=8时,Ca2+、Mg2+的存在对施氏矿物去除Cr (Ⅵ)起到明显的抑制作用,Cr (Ⅵ)的去除率从59%下降至20%左右.造成这种现象的原因可能是,弱碱性环境中,施氏矿物表面容易吸附阳离子,Ca2+、Mg2+以及生成的CaOH+、MgOH+被吸附到施氏矿物表面,导致其对Cr (Ⅵ)的吸附减少,即该条件下主要是静电吸附作用影响的.同时,对比Ca2+和Mg2+对施氏矿物吸附Cr (Ⅵ)的影响时可以看出,当Ca2+和Mg2+的含量小于8 mmol·L-1时,Ca2+的抑制作用比Mg2+明显,这主要是与它们的吸附能力有关,Ca2+和Mg2+的吸附能力顺序为Ca2+>Mg2+[30],由于该条件下施氏矿物表面带负电荷,所以Ca2+要比Mg2+与施氏矿物吸附能力强.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
25℃,180 r·min-1图 13 阳离子对施氏矿物吸附Cr (Ⅵ)的影响
3 结论
(1) 人工化学法合成施氏矿物处理不同浓度Cr (Ⅵ)污染地下水过程中,24 h后反应均可达到平衡;吸附动力学过程符合Lagergren二级速率方程,吸附主要以化学吸附为主,涉及离子交换与络合反应.吸附等温方程符合Langmiur方程,最大吸附量为40.4 mg·g-1,吸附热为6.368 kJ·mol-1,吸附机制可能为氢键力、范德华力、疏水键力和偶极间力.
(2) pH值对施氏矿物去除地下水中Cr (Ⅵ)的过程有重要影响,pH在3~8之间时Cr (Ⅵ)的去除率随pH的增大先上升后下降,施氏矿物去除Cr (Ⅵ)的最佳pH值在4.5~6之间,并在pH=6时达到最大93.1%.
(3) 地下水中的有机物对施氏矿物吸附Cr (Ⅵ)有重要影响.弱酸性环境(pH=6),有机物对施氏矿物吸附Cr (Ⅵ)无影响;当地下水为弱碱性环境(pH=8)时,有机物会对施氏矿物吸附Cr (Ⅵ)产生明显的抑制作用.
(4) 不同的无机离子对施氏矿物吸附地下水中Cr (Ⅵ)的影响不同. HCO3-、SO42-会对施氏矿物吸附Cr (Ⅵ)有明显的抑制作用,Cl-则对吸附过程无影响;无机阳离子在弱酸性环境中对施氏矿物吸附Cr (Ⅵ)无影响,但是,在弱碱性环境中会明显的抑制施氏矿物吸附Cr (Ⅵ).